Cumen được biết đến là một trong những nguyên liệu quan trọng để điều chế chế các hợp chất hữu cơ có nhiều ứng dụng thực tiễn như phenol hay axeton. Vậy bạn có biết cumen là gì, nó có tính chất ra sao và được điều chế, ứng dụng như thế nào không. Nếu câu trả lời là không thì bài viết ngày hôm nay chính là đáp án mà bạn cần tìm.
Bạn đang đọc: Cumen là gì? Quy trình sản xuất cumen thương mai
Cumen là gì?
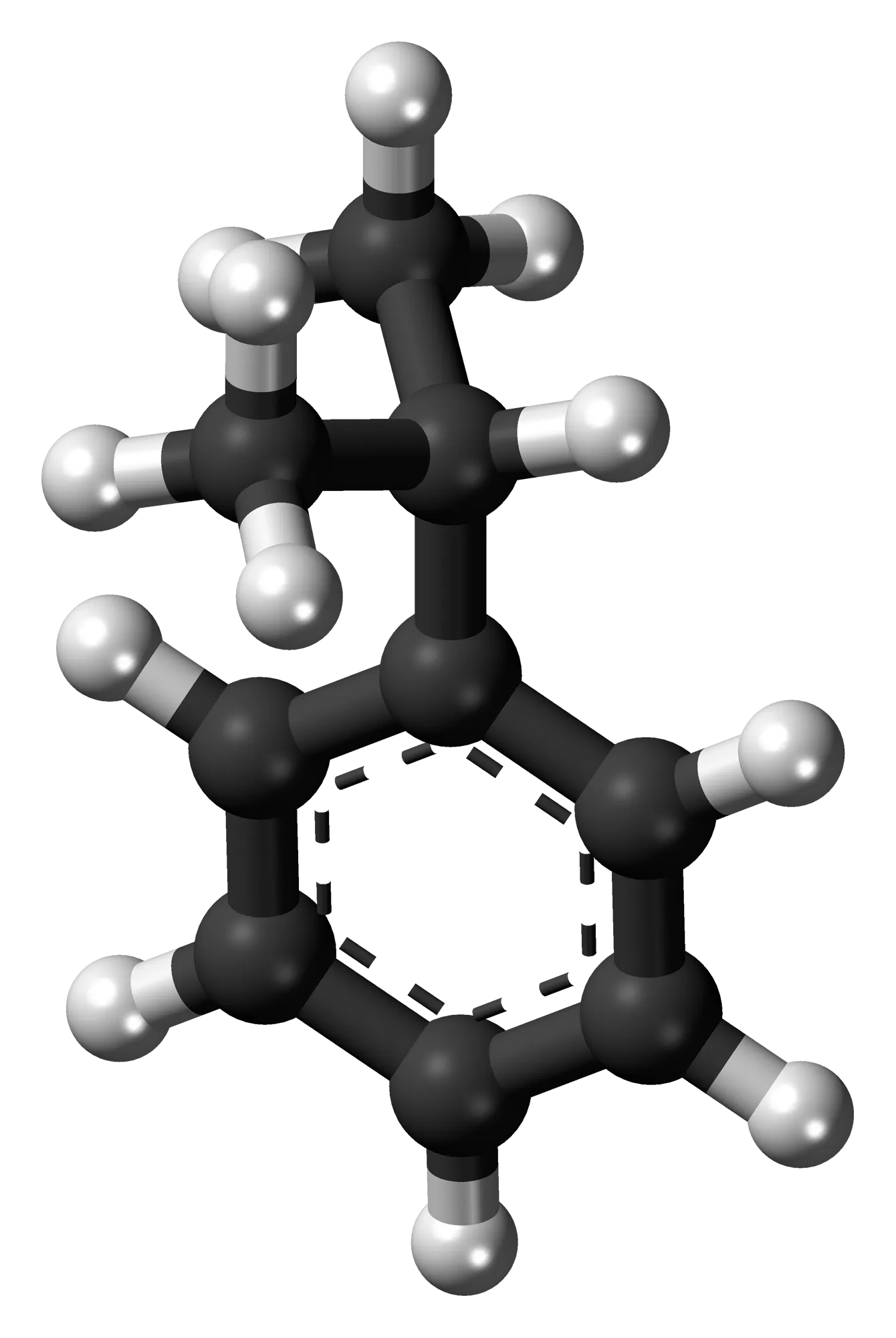
Cumen là tên thay thế của isopropylbenzene – một hydrocacbon có một nhân thơm và một nhóm thế propyl. Đồng thời, nó cũng là dẫn xuất của benzen và là thành phần của dầu mỏ, nhiên liệu tinh chế.
Cumen có công thức phân tử C9H12. Ngoài tên gọi cumen, nó còn có một số cái tên khác như 1- metyletyl benzen , Isopropyl benzen hoặc 2- phenyl propan.
Cấu trúc phân tử của cumen
Với công nghệ lọc dầu hiện nay, cumen chính là sản phẩm phụ của quá trình catalytic refoming và steam cracking. Khoảng 98% sản lượng cumen trên thế giới được dùng để làm nguyên liệu trong các nhà máy sản xuất phenol và xeton. Vì vậy mà sản lượng cumen bị phụ thuộc vào thị trường tiêu thụ của phenol và xeton.
Một số nguồn phát sinh cumen
- Cumen được thải ra trong quá trình lọc dầu và đốt cháy các sản phẩm dầu mỏ.
- Từ các quá trình công nhiệp hóa chất, sản xuất cao su, sản xuất giấy, nhựa, sơn,…
- Có trong khí thải động cơ các phương tiện giao thông, khói thuốc lá, sơn, vecni,….
- Cumen cũng được tìm thấy trong một số sản phầm tiêu dùng như đồ gỗ nội thất, sơn, nhựa cách điện, cao su trải sàn và tường, keo xịt,…
Đặc trưng tính chất của cumen
1. Tính chất vật lý
– Cumen là chất dễ cháy với có điểm sôi là 152 °C.
– Ở nhiệt độ thường, cumen tồn tại ở dạng lỏng, không màu, dễ bắt lửa và có mùi gần giống như xăng.
– Độ tan: Không tan trong nước nhưng tan trong các dung môi hữu cơ như dietyl ete, tetraclorua cacbon, hexan.
– Khó cháy hơn các hydrocacbon thơm khác nhưng giới hạn cháy lại rất cao.
– Là chất độc hại, chỉ kém benzene.
2. Tính chất hóa học
Vì là dẫn xuất của benzene nên cumen có đầy đủ tính chất của vòng benzen và gốc alkyl, bao gồm:
+> Phản ứng thế
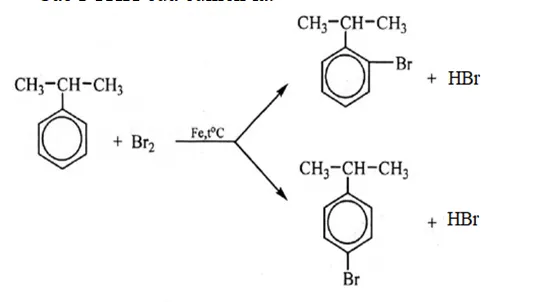
– Phản ứng thế halogen:
- Phản ứng với Br2 khan trong điều kiện nhiệt độ, có xúc tác là sắt: Nguyên tử brom thế vào nhân benzen
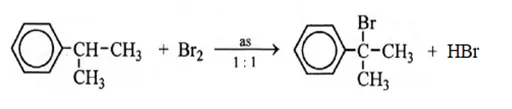
- Phản ứng với Br2 khi được chiếu sáng: Nguyên tử Br sẽ thế vào nhóm alkyl
– Phản ứng thế nitro trong điều kiện nhiệt độ, có xúc tác là H2SO4.
– Phản ứng Sunfua hóa.
+> Phản ứng cộng
Phản ứng cộng H2 trong điều kiện nhiệt độ, áp suất 10at và có xúc tác Niken.
+> Phản ứng oxy hóa
- Đun nóng cumen được dung dịch làm mất màu thuốc tím KMnO4
- Cumen phản ứng với Oxy không khí ở nhiệt độ cao và không có xúc tác sẽ tạo thành cumen hydroperoxit (tiến hành trong pha lỏng)
C6H5- CH(CH3)2 + O2→ C6H5- CH(CH3)2OO
Nếu có xúc tác là axit H2SO4 loãng thì peroxit phản ứng với axit và tạo ra phenol, axeton.
C6H5- CH(CH3)2OOH → C6H5OH + CH3COCH3
Điều chế cumen bằng cách nào
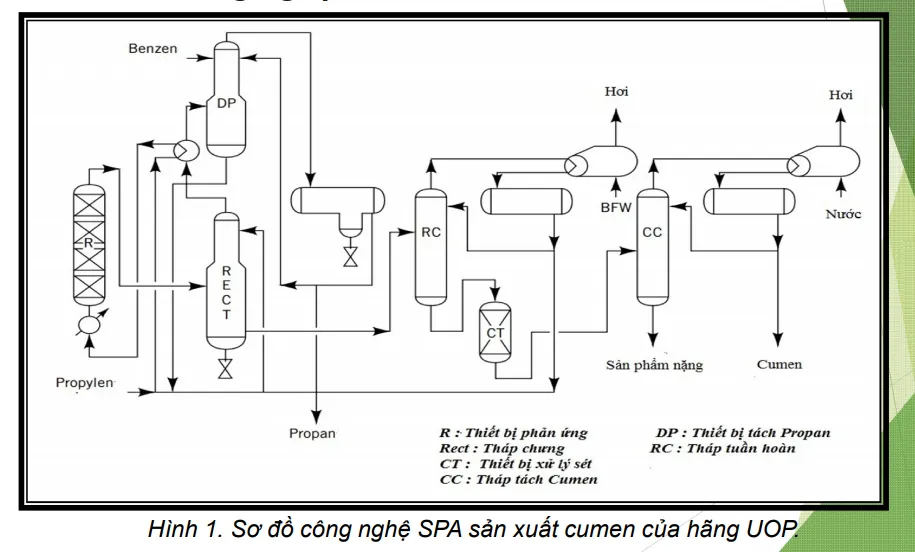
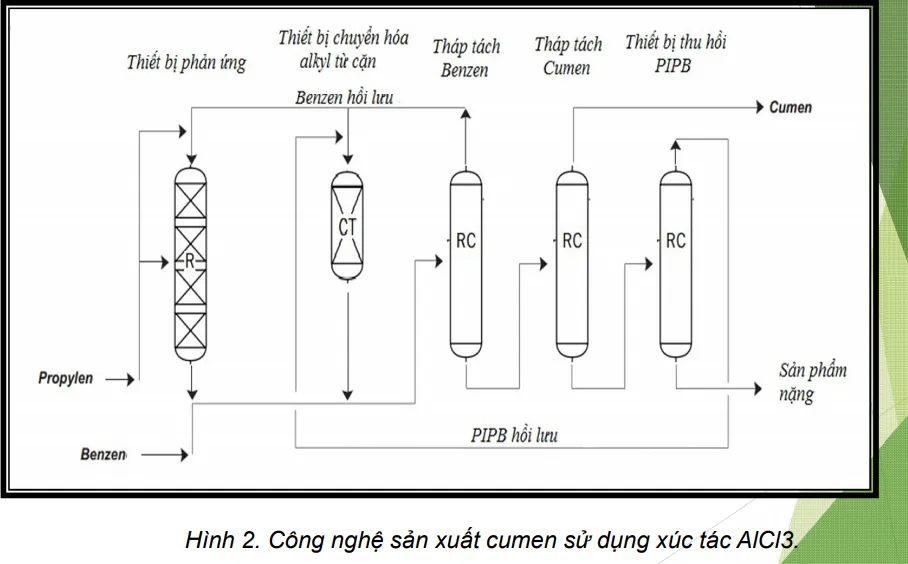
Trong công nghiệp, cumen thương mại được sản xuất bằng phản ứng ankyl hóa Friedel-Crafts benzene và propylene. Trước đây, hỗn hợp axit photphoric và nhôm được dùng làm chất xúc tác nhưng từ giữa những năm 1990, người ta đã chuyển sang dùng chất xúc tác khác là zeolite.
Cumen có độc không?
Theo cơ quan bảo vệ môi trường của Hoa Kỳ, cumen là hóa chất có độc tính thấp, chỉ đạt 11 điểm trong thang điểm 100 với 100 độc tố cao nhất. Đánh giá này chủ yếu dựa vào hai yếu tố, đó là hàm lượng tối thiểu mà cumen có thể gây ảnh hưởng đến sức khỏe và các triệu chứng đau đầu, đỏ mặt, chóng mặt,… khi tiếp xúc với hóa chất.
Khi tiếp xúc với da: Gây kích ứng da, nổi mẩn đỏ. Nếu phơi nhiễm lâu dài có thể gây ảnh hưởng đến gan, phổi, thận.
Hít phải hơi cumen: Nạn nhân sẽ chóng mặt, buồn ngủ, thậm chí hôn mê.
Nuốt nhầm cumen: Nạn nhân sẽ bị ho, đau họng, đau bụng, nôn ói, thậm chí có thể gây tử vong.
Ứng dụng của cumen
– Khoảng 98% sản lượng cumen trên thế giới được sản xuất hiện nay được dùng làm nguyên liệu tại các nhà máy sản xuất phenol và axeton.
– Sử dụng để sản xuất α-metylstyren, α-metystyren. Đây là loại hóa chất trung gian dùng trong công nghiệp sản xuất chất chất dẻo, nhựa, gạch lát sàn nhà, chất kết dính,….
– Là dung môi của các loại sơn, keo xịt, men và là một thành phần của động cơ nhiên liệu có chỉ số octan cao.
– Dùng trong công nghiệp sản xuất sắt, cao su, thép, bột giấy và công nghệ liên quan đến quá trình oxy hóa phenol.
Lưu ý khi bảo quản và sử dụng cumen
Bảo quản trong thùng kín. Đồng thời, khu vực bảo quản phải khô ráo, thoáng mát, tránh tiếp xúc với ánh sáng mặt trời, nguồn phát nhiệt và các chất oxy hóa.
Khi sử dụng cần phải trang bị đồ bảo hộ như như kính, găng tay,….Sau khi sử dụng và vận chuyển hóa chất phải rửa sạch tay bằng xà phòng.
Bài tập ví dụ về cumen
a) Để sản xuất cumen, người ta cho benzen tác dụng với propen có xúc tác axit. Viết phương trình hoá học của phản ứng.
b) Để sản xuất 1 tấn cumen cần tối thiểu bao nhiêu m3 (đktc) hỗn hợp khí tách được từ khí crcakinh với tỷ lệ về thể tích là 60% propen và 40% propan? Biết rằng hiệu suất phản ứng đạt 80%.
c) Viết phương trình hoá học xảy ra khi cho 1mol cumen tác dụng với:
- 1mol brom có mặt bột Fe
- 1mol brom có chiếu sáng
Giải:
a) Phương trình phản ứng giữa benzen và propen
Tìm hiểu thêm: "Cổ súy" &"cổ xúy" là gì? Tìm hiểu nghĩa đúng của từ

b) Ta có nC3H6= ncumen=106/ 120 mol ⇒ VC3H6=(106/120).22,4≈186666,7l≈186,7m3 ⇒ Vhh = (186,7.100%)/60% ≈ 311 m3
Vì hiệu suất phản ứng là 80% nên Vhh = (311.100%)/80% = 388,75 m3
c) Phương trình hoá học xảy ra khi cho 1mol cumen tác dụng với:
- 1mol brom có mặt bột Fe
- 1mol brom có chiếu sáng
>>>>>Xem thêm: Bạn đã hiểu hết về vai trò của affiliation trong CV là gì chưa?